Akku oder Batterie?
Batterien und Akkus findet man überall im Alltag. Gerade in der Elektromobilität werden diese beiden Begriffe oft synonym verwendet. Genau genommen unterscheidet man zwischen nicht-aufladbaren Primärbatterien (umgangssprachlich Batterien) und wiederaufladbaren Sekundärbatterien (Akkumulatoren, kurz Akkus). Beide haben einen ähnlichen Aufbau, unterscheiden sich aber in ihrem elektrochemischen Verhalten. Um die Verwechslung zu vermeiden, wird an dieser Stelle von Akkus gesprochen.
Die einzelne Akkuzelle bildet die kleinste Einheit des Fahrzeug-Energiespeichers. Dieser setzt sich aus hunderten oder tausenden dieser Zellen zusammen, die oft in Modulen angeordnet sind und zu einem Gesamtpaket zusammengeschaltet werden. Zum Beispiel werden 96 Lithium-Ionen-Zellen mit einer Spannung von je 4,2 Volt in einer Reihenschaltung zusammen verbunden, um eine Akkuspannung von 404 Volt zu erzielen.
Aufbau einer Zelle
Wie jede handelsübliche Batterie hat auch die Akkuzelle zwei Pole. Diese sind im Inneren mit zwei Elektroden verbunden. Bei einem Lithium-Ionen-Akku besteht die sogenannte Kathode (Pluspol) aus einem Lithium-Metalloxid, welches auf einer Aluminium-Trägerfolie aufgebracht ist. Die Kathode ist in der Lage, Lithium-Ionen abzugeben, diese bilden dann den benötigten sogenannten Ladungsträger beim Laden und Entladen. Die Anode (Minuspol) ist in der Regel aus Grafit, welches von einer Kupferfolie getragen wird. Das Grafit der Anode kann besonders gut Lithium-Ionen aufnehmen, ohne dabei eine feste chemische Bindung einzugehen. Beide Elektroden sind von einem leitenden meist flüssigen Elektrolyten umgeben, der den Transport der Lithium-Ionen zwischen Kathode und Anode sicherstellt. Er besteht aus einem organischen Lithium-Salz. Damit keine Elektronen durch den Elektrolyten fließen, werden die Kathode und die Anode durch einen Separator voneinander getrennt. Dieser Separator besteht aus einem mikroporösen Kunststoff (z.B. ein Vlies aus Glasfaser oder Polyethyl) oder aus einer keramischen Membran und ist für die Lithium-Ionen durchlässig, aber nicht für die Elektronen. So wird ein innerer Kurzschluss zwischen den Elektroden verhindert.
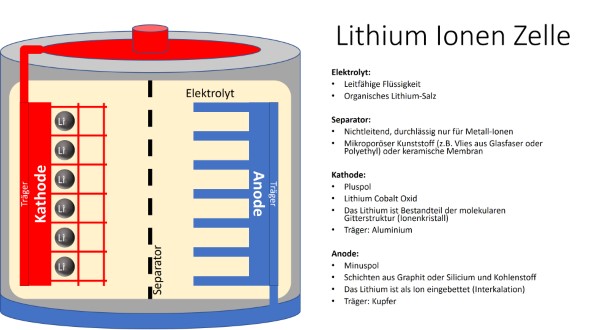
Das Funktionsprinzip einer Lithium-Ionen-Akkuzelle
Wie man es von gewöhnlichen Batterien z.B. aus Taschenlampen kennt, hat die Zelle einen Pluspol und einen Minuspol. Wird der Zelle elektrische Energie entnommen, fließen die negativ geladenen Elektronen vom Minuspol zum Pluspol (sogenannte physikalische Stromrichtung). Das ist nicht zu verwechseln mit der technischen Stromrichtung von Plus nach Minus, wie man es im Physikunterricht gelernt hat. So oder so muss die Zelle zunächst geladen werden, damit dieser Stromfluss möglich ist.
Bei der ungeladenen Zelle sind die Lithium-Atome zunächst eingebunden in der kristallinen Struktur der Kathode aus Metalloxid. Wird nun eine Ladespannung von außen an die Elektroden angelegt, dann „saugt“ diese externe Spannung die Elektronen vom Lithium-Atom durch den Pluspol der Zelle in Richtung Anode. Die Lithium-Atome werden durch das Wegnehmen des Elektrons zum Ion (positiv geladen) und versuchen, ihrem Elektron zu folgen. Sie dringen durch den Elektrolyten und den für Ionen durchlässigen Separator und lagern sich auf der Anode in das schichtartige Grafit ein. Wird nun die Ladespannung entfernt, dann bleiben die Lithium-Ionen und die Elektronen auf der Anode. Sie würden zwar gerne wieder zurück zur stabilen Kristallstruktur der Kathode fließen (wie von einem unsichtbaren Gummiband gezogen), können sich aber nicht von den Elektronen auf der Anode trennen, zumal diese nicht mit durch den Separator zurückwandern können. Dieser Gummiband-Effekt bewirkt die Spannung der geladenen Akkuzelle.
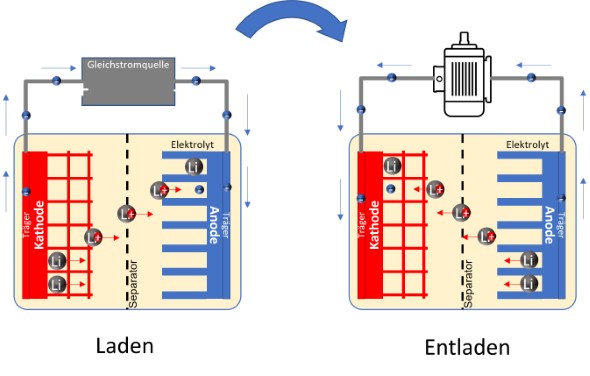
Ein an die geladene Akkuzelle angeschlossener Verbraucher wie z.B. ein Elektromotor erzeugt einen äußeren Stromkreis an der Zelle, der für die Elektronen auf der Anode endlich wieder eine Möglichkeit bietet, sich zur Kathode zurückzubewegen. Jetzt können sich die Lithium-Ionen (quasi vom gedanklichen Gummiband gezogen) wieder zurück zur Kathode bewegen, während die Elektronen durch den äußeren Stromkreis durch den Verbraucher hindurch ebenfalls zurückfließen. Dieser Stromfluss durch den Verbraucher erzeugt die dort gewünschte Leistung und der Akku entlädt sich.
Warum Lithium?
Das beschriebene Funktionsprinzip gilt für alle Metall-Ionen-Akkus. Aber heute wird dennoch bevorzugt auf Lithium als Ladungsträger gesetzt. Aufgrund seiner chemischen Eigenschaften und seiner Position im Periodensystem der Elemente ist Lithium das optimale Material als Ladungsträger:
- Lithium ist ein sogenanntes Alkalimetall. Das Lithium-Atom hat auf der äußeren Elektronenschale nur ein einzelnes Elektron (Valenzelektron), was sich deshalb besonders leicht herauslösen lässt. Man spricht von einer sehr guten Ionisierbarkeit.
- Lithium hat unter den infrage kommenden Metallen das geringste Atomgewicht (Ordnungszahl 3 im Periodensystem; 3 Protonen, 3-4 Neutronen). Lithium bringt also als Ladungsträger wenig Eigengewicht auf die Waage und man kann damit Akkuzellen mit einer hohen Energiedichte herstellen.
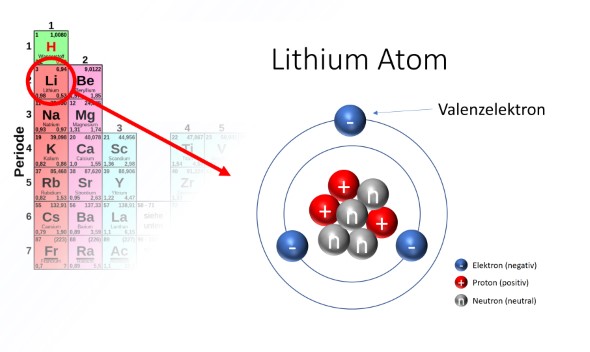
Stand heute kommen als einzige Alternativen die Alkalimetalle Natrium und Kalium, die Erdalkalimetalle Magnesium und Kalzium oder die Metalle Aluminium und vielleicht noch Gallium in Frage. In Bezug auf Ionisierbarkeit und Gewicht sind sie alle schlechter geeignet als Lithium, haben aber teilweise Vorteile in Bezug auf Verfügbarkeit und Kosten. Alle anderen Metalle haben ein höheres Gewicht, lassen sich schwerer ionisieren, sind schlecht verfügbar und teilweise sehr giftig.
Die Zellchemie bei Lithium-Ionen-Akkus
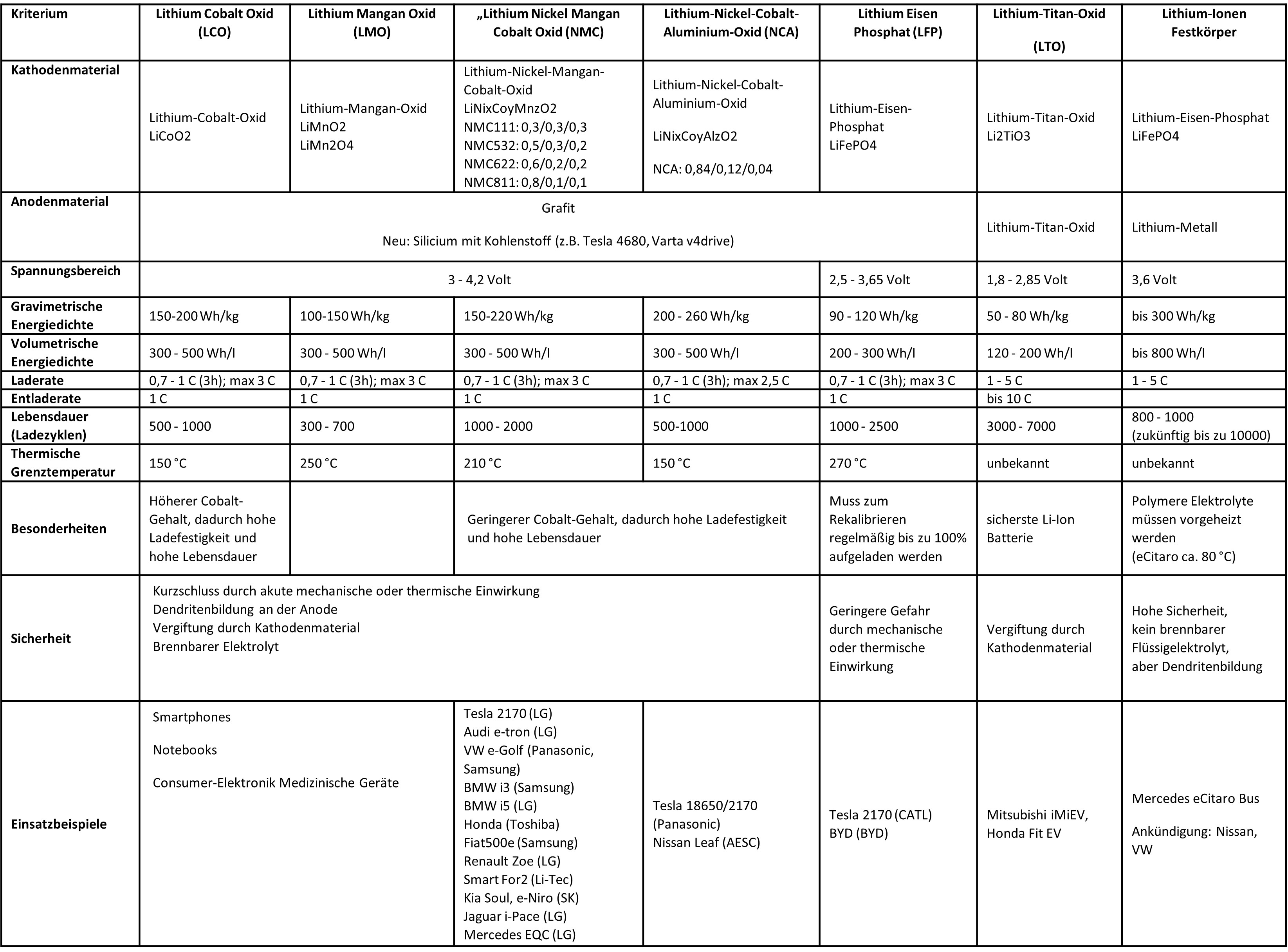
Innerhalb der Gruppe der Lithium-Ionen-Akkuzellen gibt es verschiedene Zusammensetzungen der Materialien für die Kathode und den Elektrolyten, die in unterschiedliche Eigenschaften resultieren. Die folgende Tabelle zeigt die wichtigsten Unterschiede. Dabei werden verschiedene Kriterien zum Vergleich herangezogen.
Eine zentrale Frage ist die Baugröße und das Gewicht des Akkus. Deshalb ermittelt man die sogenannte Energiedichte auf zwei Bezugsgrößen: Die gravimetrische Energiedichte entspricht der Menge an Energie (Wh; Wattstunden) bezogen auf das Gewicht der Akkuzelle (Wh/kg; Wattstunden pro kg), die volumetrische Energiedichte der Menge an Energie bezogen auf die Baugröße der Akkuzelle (Wh/L; Wattstunden pro Liter). Während sich bei Elektroautos Größe und Gewicht direkt auf die Nutzbarkeit des Fahrzeugs auswirken, spielt das zum Beispiel bei stationären Speichersystemen eine geringere Rolle.
Die Lade- und Entladerate (sogenannter C-Koeffizient) ermittelt sich aus dem Verhältnis zwischen Akkuzellenkapazität (Wattstunden) und Lade-/Entladeleistung (Watt). Wenn ein Akku mit 100 kWh Kapazität mit einer Leistung von 100 kW eine Stunde lang lädt, dann entspricht das einer Laderate von 1 C. Zur Bewertung einer bestimmten Zellchemie ermittelt man die C-Rate einerseits als den Durchschnittswert über die gesamte Ladekurve als auch den Maximalwert, siehe Tabelle.
Die Lebensdauer einer Akkuzelle wird in Vollladezyklen definiert. Ein Vollladezyklus entspricht einer Ladung von 0 % auf 100 %, wobei sich der Vollzyklus aus den tatsächlichen Einzelladevorgängen aufaddiert. Geht man bei einem Fahrzeug von einer Reichweite von beispielsweise 400 km bei 100 % Ladung aus, dann ergibt sich bei 1000 Ladyzyklen eine theoretische Gesamtkilometerleistung des Fahrzeugs von 400.000 Kilometern.
Übrigens ist es üblich, dass bei einem Akku die Kapazität bereits in den ersten Monaten leicht abnimmt (bis zu 5%). Danach bleibt sie über die Lebensdauer des Akkus zunächst stabil. Die genaue Lebensdauer hängt nicht nur von der Zellchemie ab, sondern auch davon, wie schonend der Akku während seiner Lebenszeit behandelt wurde. Je nach Nutzung lagern sich mit der Zeit Lithium-Atome als dauerhafte Metallschicht auf die Anode. Diese Atome fehlen dann als Ladungsträger und behindern die verbleibenden Lithium-Ionen bei ihrer Bewegung. Dadurch sinkt die Kapazität des Akkus und es kommt zur normalen Alterung der Zelle. Die Akkuzelle fällt in der Regel nicht schlagartig aus. Beim Erreichen einer Restkapazität von 70% bis 75% beschleunigt sich der Verfall. Wenn zu viele Zellen des Akkus diesen Zustand erreicht haben, spricht man von einem Defekt.
Quelle: https://batteryuniversity.com/article/bu-205-types-of-lithium-ion
Lithium-Ionen-Akkuzellen mit einer Kathode aus reinem Cobalt- oder Mangan-Oxid (LCO und LMO-Chemie) werden aktuell primär bei Smartphones und anderen Elektronikgeräten eingesetzt. Sie sind robust, dafür nicht sehr langlebig und haben einen hohen Anteil an Cobalt bzw. Mangan, deren Verwendung man aus Umweltgesichtspunkten heraus reduzieren will.
Die meisten aktuellen batterieelektrischen Fahrzeuge haben Akkus, deren Kathode aus einer Mischung von Lithium-Nickel-Mangan und Cobalt besteht (NMC). Dabei kann die Zusammensetzung der einzelnen Stoffe variieren (siehe Verteilung in der Tabelle). Die Unterarten werden entsprechend z.B. NMC111, NMC532 und die neueste Generation NMC811 genannt (8 Teile Nickel, 1 Teil Mangan, 1 Teil Cobalt). Ziel ist es, den Anteil am teuren Cobalt möglichst weiter zu reduzieren und dabei die Zelle trotzdem mit einer guten Laderate und Lebensdauer zu versehen.
Wie auch bei den NMC-Akkus, gibt es bei den etwas älteren NCA-Akkus eine gewisse Gefahr des thermischen Durchbruchs, etwa durch Überhitzung oder bei mechanischer Einwirkung auf die Zelle. Außerdem neigen diese Zellen zur sogenannten Dendritenbildung. Diese Dendriten entstehen auf der Anode insbesondere bei hoher Belastung der Zelle durch Schnellladen und Vollladen, indem sich die Lithium-Ionen nicht mehr lose durch den Elektrolyten bewegen, sondern sich als Metallnadeln auf der Grafitgrenzschicht ablagern. Bei extremer Belastung können die Dendriten richtige Äste bilden, die den Separator durchstoßen und damit einen Kurzschluss innerhalb der Zelle verursachen können. Das moderne Batterie-Management-System verhindert das weitestgehend durch eine gezielte Kontrolle der Belastung beim Laden und Fahren.

Gerade bei Tesla hat der Lithium-Eisen-Phosphat-Akku (LFP) aus der Mitte der 1990er Jahre eine Renaissance erlebt. Speziell für die Standard-Range Modelle vom Model 3, die weniger anspruchsvoll in Bezug auf Reichweite sind, kann man diese preisgünstige Akkutechnologie einsetzen, obwohl sie eine geringere Energiedichte hat im Vergleich zu NMC- oder NCA-Zellen. Dabei ist dieser Typ sogar weniger empfindlich gegen Überhitzung und mechanischer Einwirkung auf die Zelle. Als Besonderheit bleibt zu erwähnen, dass im Gegensatz zu den anderen Lithium-Ionen-Zellen das regelmäßige Aufladen auf 100 % nicht schädlich ist, sondern sogar empfohlen wird. Damit soll der sogenannten „Anomalie der Entladekurve“ entgegengewirkt werden, die zu einer Dekalibrierung des Ladezustands führt. Man spricht auch von dem „Memory-Effekt“ des LFP-Akkus; nicht zu verwechseln mit dem Memory-Effekt früherer Nickel-Mangan-Akkus, bei denen sich die Kapazitätsgrenze verschoben hat durch häufiges Zwischenladen.
Lithium-Titan-Oxid-Akkus (LTO) spielen heute noch keine große Rolle. Mitsubishi und Honda haben erste Fahrzeuge damit im Einsatz. Insbesondere die Herstellung ist wegen des Anteils von Titan kostspielig. Bei Lithium-Ionen-Festkörper Akkus kommt ein Elektrolyt zum Einsatz, der nicht mehr flüssig ist, sondern fest. Das vereinfacht nicht nur die Produktion, sondern erhöht die Sicherheit, weil der Elektrolyt keine brennbare Flüssigkeit mehr enthält. Dazu kommt kein Grafit auf der Anode zum Einsatz, sondern Lithium in metallischer Form, was sich sehr positiv auf die Energiedichte auswirkt (Faktor 2-3). Erste Erfahrungen mit Feststoffakkus sammelt Mercedes mit dem eCitaro Bus. Es ist damit zu rechnen, dass diese Technologie in der Zukunft weiterentwickelt wird und in wenigen Jahren neue Anwendungsgebiete erschließt.
Innerhalb der Spezifikation dieser Typen von Lithium-Ionen-Akkuzellen hat jeder Hersteller seine eigenen Produktionsverfahren und Zusatzstoffe entwickelt. Zum Beispiel setzt man dem Elektrolyten diverse Additive bei, um die Effizienz und Lebensdauer der Zelle weiter zu erhöhen und den Innenwiderstand zu verringern. Es ist davon auszugehen, dass die Entwicklung bei allen Zelltypen weiter voranschreitet und sich dadurch weitere Verbesserungen der Leistungsdaten ergeben. Auch Tesla verbessert die Zusammensetzung der Zellen kontinuierlich zusammen mit den Partnern LG, Panasonic und CATL. Bei den neuen sogenannten 4680er-Zellen wird auf der Anode zum Beispiel Silizium anstatt Grafit eingesetzt, um die Speicherfähigkeit für Lithium-Ionen zu erhöhen.
Alternativen zur Lithium-Ionen Akkuzelle
Wie bereits beschrieben, ist Lithium Stand heute das optimale Element für die Herstellung von leistungsstarken Metall-Ionen-Akkuzellen. Wenn es beim Akku nicht primär auf die Performance und die hohe Kapazität ankommt, sondern eher auf den Preis, dann könnten zukünftig auch andere ionisierbare Metalle an die Stelle von Lithium treten. Zurzeit arbeiten Zellhersteller fieberhaft an Alternativen mit Aluminium- und Magnesium-Ionen-Akkus. Insbesondere CATL hat erste Akkus mit einer Natrium-Ionen-Technologie für 2023 angekündigt. Diese Akkus haben eine geringere Energiedichte als die meisten Lithium-Pendants, aber sie sind deutlich günstiger in der Herstellung und genauso langlebig. Auch neigen diese Metalle nicht zur Dendritenbildung und erhöhen die Sicherheit des Systems. Experten rechnen mit der kommerziellen Nutzbarkeit in drei bis fünf Jahren.
In noch fernerer Zukunft sieht man Metall-Schwefel-Akkus. Diese sollen als Alternativen zum Metall-Ionen Akku eine noch höhere Energiedichte haben und sich sogar für den Einsatz in Schiffen und Flugzeugen eignen. Die Forschung dazu steht aber noch ganz am Anfang. Ein Kernproblem ist zurzeit noch die fehlende Langlebigkeit.
Bei SALD-Akkus (Spatial Atomic Layer Deposition) handelt es sich nicht um eine neue Zellchemie, sondern es geht eher um das Verfahren, wie beim Akkus die Kathoden- und Anodenmaterialien in Schichten mit der Dicke eines Atoms aufgetragen werden können. Dadurch entsteht eine größere Materialoberfläche an der Grenzschicht, die für die Herauslösbarkeit der Metall-Ionen zuträglich ist. Der Akku erreicht einen signifikant besseren Innenwiderstand, wärmt sich bei Belastung kaum auf und erhält eine deutlich höhere Energiedichte. Das Aufladen bis 80% soll in 10 Minuten erfolgen und eine Akkuladung für eine Reichweite von fast 2000 km ausreichen bei einer Baugröße, die vergleichbar mit heutigen Lithium-Ionen-Akkus ist.
Weitere Erkenntnisse erwartet man sich von der Erforschung von Akkus mit wässrigem Elektrolyten. Zum Beispiel „Salzwasserakkus“ werden sich auf absehbare Zeit vor allem für den stationären Einsatz zur Unterstützung der Energiewende eignen. Für den Einsatz in Fahrzeugen wird die Energiedichte über lange Zeit nicht ausreichend sein.
Fazit
Bedenkt man, dass das genaue Zusammenspiel von Zellchemie, Ladungsträger und deren Verhalten an den sogenannten Grenzschichten bei Lithium-ionen-Zellen bis heute nicht vollständig erforscht ist, erscheint es plausibel, warum der Akku das eigentliche technische Wunder der Elektromobilität zu sein scheint. Der Lithium-Ionen-Akku wird für die nächsten 10 Jahre die Technologie der Wahl sein, wenn es um hochleistungsfähige langlebige Akkuzellen für den Einsatz in batterieelektrischen Fahrzeugen geht. Die Möglichkeiten dieser Technologie sind dabei längst nicht ausgeschöpft. Angesichts der laufenden Forschung mit vielversprechenden Werkstoffen und neuen Produktionsmethoden werden sich die Akkus in großen Schritten weiterentwickeln und es ist längst kein Ende in Sicht. Diese Technologie hat das Potenzial, ein echter Game Changer in der Verkehrswende als auch in der Energiewende zu sein, insbesondere wenn man in der Entwicklung auch auf Deutsche Ingenieurstugenden und Erfindergeist setzt.

Das T&Emagazin
Der Artikel ist erschienen in der Ausgabe 15 (Juli 2022) des T&Emagazins.
(Online Lesen)
Das T&Emagazin entsteht durch Beiträge der Community und behandelt Themen rund um E-Mobilität und Energiewende.
Das T&Emagazin ist an rund 350 Auslageorten im deutschsprachigen Raum kostenlos zu finden. Interessierte, die das Heft bequem zuhause im Briefkasten haben wollen, können es jedoch auch gegen Übernahme der Versand- und Portokosten über den T&Eshop anfordern. Wer 5, 10 oder auch 20 Hefte haben möchte, kann bequem entsprechende Pakete ordern. Zudem besteht die Möglichkeit, das T&Emagazin in Wunschmenge dauerhaft zu abonnieren.

